Confocal Nikon haut débit AX LIPSI
LIPSI
Le LIPSI est une solution pour le criblage de lames et/ou plaques multipuits entièrement incubées. Il peut accueillir jusqu’à 20 plaques ou 60 lames. À cette échelle, les expériences peuvent s'affranchir du biais humain, et même des événements rares peuvent être observés avec une pertinence statistique. Afin de fournir le meilleur système, Nikon Instruments Europe a développé en collaboration avec Life Imaging Services (LIS) et Prior une solution complète entièrement incubées autour du Ti2-E.
- la manipulation des lames et plaques se fera en toute autonomie afin de les déposer sur la platine et de les récupérer. 25 inserts pour lame sont fournis dans l’offre ;
- Les plaques/lames peuvent être placées dans l’incubateur : thermostaté, sous atmosphère contrôlée (CO2) avec contrôlé de l’humidité. Les utilisateurs ont la liberté de choisir leur température et le pourcentage de CO2. Le système peut aussi être utilisé à température ambiante ;
- Le LIPSI possède deux parties indépendantes, platine au niveau de la zone de travail et la partie incubation. Ces deux parties possèdent un contrôleur de CO2 chacun.
- En fonction des besoins, la partie robotique peut ne pas être utilisée, conservant la simplicité d’utilisation d’un microscope classique. Visualisation aux oculaires de l’échantillon, mise en place manuelle sur la platine de l’échantillon etc …
- La partie robotique est entièrement pilotée par le logiciel propriétaire NIKON, NIS-Elements, même logiciel qui pilote toute la gamme de microscopie.
- Le LIPSI peut être utilisé avec le confocal ou avec la caméra ou les deux. Il devient alors très facile de screener des tissus grâce à la caméra couleur et de zoomer en qualité confocal sur une partie à analyser.
- la manipulation des lames et plaques se fera en toute autonomie afin de les déposer sur la platine et de les récupérer. 25 inserts pour lame sont fournis dans l’offre ;
- Les plaques/lames peuvent être placées dans l’incubateur : thermostaté, sous atmosphère contrôlée (CO2) avec contrôlé de l’humidité. Les utilisateurs ont la liberté de choisir leur température et le pourcentage de CO2. Le système peut aussi être utilisé à température ambiante ;
- Le LIPSI possède deux parties indépendantes, platine au niveau de la zone de travail et la partie incubation. Ces deux parties possèdent un contrôleur de CO2 chacun.
- En fonction des besoins, la partie robotique peut ne pas être utilisée, conservant la simplicité d’utilisation d’un microscope classique. Visualisation aux oculaires de l’échantillon, mise en place manuelle sur la platine de l’échantillon etc …
- La partie robotique est entièrement pilotée par le logiciel propriétaire NIKON, NIS-Elements, même logiciel qui pilote toute la gamme de microscopie.
- Le LIPSI peut être utilisé avec le confocal ou avec la caméra ou les deux. Il devient alors très facile de screener des tissus grâce à la caméra couleur et de zoomer en qualité confocal sur une partie à analyser.
CONFOCAL AX R HD25
La tête confocale AX contient 6 emplacements motorisés avec des miroirs dichroïques internes nouvelle génération, exclusivement fournis par NIKON (brevet NIKON). Les dichroïques présents vous permettront d’utiliser toutes les raies laser proposées. L’un de ces emplacements contient aussi un séparateur de faisceau 20/80. Le positionnement de ces dichroïques avec un angle de 8° et des coating spécifiques développés par Nikon permettent d’atteindre une transmission de 99% ainsi que des bandes de réflexion de largeur spectrale maximale de 5 nm. En fonction de l’acquisition, automatiquement le miroir dichroïque adéquat est sélectionné par le logiciel.
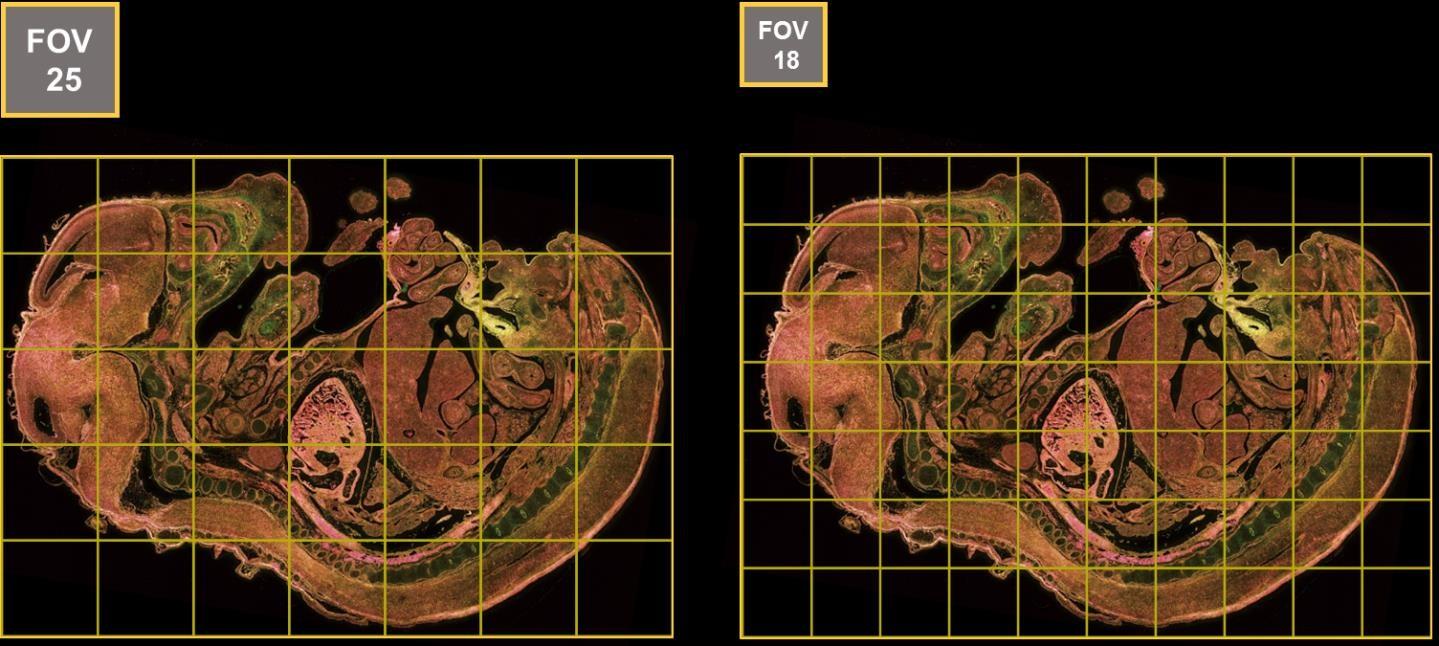
La tête confocale AX contient un système de scanner unique capable d’exploiter les 25mm d’imagerie du Ti2E (image 6). Cette capacité permet d’acquérir de larges échantillons en imageant moins de champs (environ 2 fois moins de champs). Cela permet de diminuer nettement le temps d’acquisitions de coupes végétales ou des organoïdes.
Différence d’échantillonnage entre le champ de 25 mm (Nikon) et le champ de 18 mm. Ce champ est parfaitement adapté pour les échantillons épais et les coupes de tissus:
-
Scanner résonnant
Le scanner résonnant est aussi capable d’imager à une résolution :
- 1024x1024 a 15 images/sec
- 2048x2048 a 7.5 images/sec
Le résonant fonctionne en plein champ (sans zoom), soit 25mm de champ observable en mode galvanométrique et résonnant ce qui correspond à :
2x : 9 mm x 9 mm
20x : 900 um x 900 um
40x : 450 um x 450 um
60x : 300 um x 300 um
L’imagerie via le scanner résonnant en 2048x2048 permet de pouvoir imager à haute vitesse au critère de Nyquist (critère haute résolution) vos échantillons sur un champ de 25mm tout en limitant le photoblanchiment grâce à ce mode de balayage. Cette méthode s’avère donc particulière adaptée à l’imagerie d’échantillons vivants.
-
Scanner Galvanométrique
- 10 images/sec en 512x512 en mode bidirectionnel zoom 8
- 2.5 images/sec en 1024x1024 en mode bidirectionnel zoom 1
Il est aussi possible d’imager avec ce scanner jusqu’à une résolution de 8192x8192 permettant d’échantillonner de façon optimale votre échantillon en un seul passage à zoom 1.
Le mode d’acquisition bidirectionnel pourra être calibré automatiquement par une procédure logicielle ou manuellement.
-
Détecteurs spectral – DUX-VB
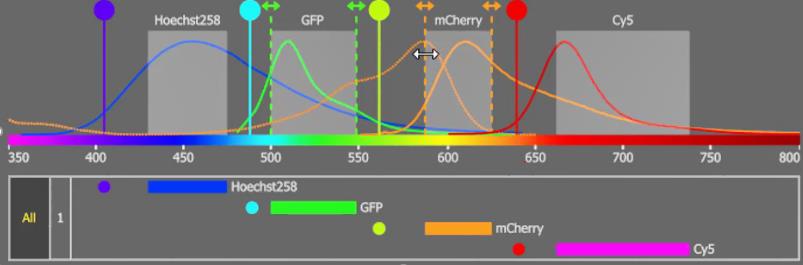
Ces détecteurs ont été développés par Hamamatsu. Les détecteurs GaAsP sont développés pour Nikon offrent un rendement quantique 2 fois plus élevé (45% d’efficience quantique à 500 nm) que les détecteurs classiques sur la plage de longueur d’onde médiane avec un rapport signal/bruit très amélioré comparé aux PMT classiques. Cette solution permet d’acquérir en 4 couleurs simultanément.
Détection spectrale : Cette unité de détection est le modèle spectral équipé de filtres à longueur d'onde variable. Les deux détecteurs GaAsP sont équipés de filtres à longueur d'onde variable qui peut spécifier la longueur d'onde d'acquisition de la fluorescence. Ce système permet de s’affranchir de l’autofluorescence des tissus (Image 8). Il est aussi possible de réaliser une gamme spectrale avec une résolution de 5 nm et de réaliser de la déconvolution spectrale, même en live.
Mis à jour le 24 janvier 2024.





